谷歌DeepMind将推出新一代AlphaFold,不单止预测蛋白质结构
2020年,DeepMind的AlphaFold AI系统以前所未有的准确性预测了蛋白质的结构,使研究人员感到震惊。现在,谷歌和生物技术初创公司Isomorphic Labs已经展示了AlphaFold的下一代,展示了其在蛋白质以外的领域,如DNA、RNA、小分子配体和翻译后修饰(PTM)复合物方面的显著扩展能力。
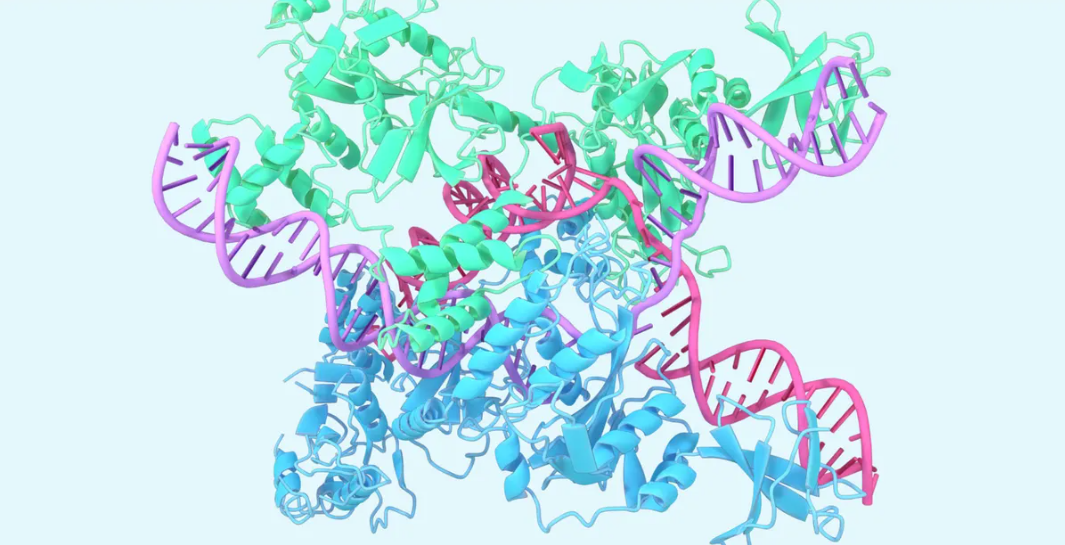
这一进展巩固了AlphaFold作为一种多功能工具,可以加快对生物学和药物开发方面的新发现。虽然最初的AlphaFold改变了蛋白质折叠预测,但最新模型提供了驱动生物机制的多种分子的更完整的图像。最新模型现在可以预测几乎所有蛋白数据银行(PDB)中的分子,通常达到原子级的准确性。
新的AlphaFold模型实现了配体、核酸和PTM等主要分子类别的高精度预测,这些分子类别在启动关键细胞过程中起着重要作用,但以前很难准确地建模。例如,PTM通过磷酸化等化学修饰方式调控蛋白质的活性,对于涉及到癌症的细胞信号通路是至关重要的。
对于配体来说,AlphaFold的全新结构预测显著超越了分子对接这一药物发现行业中标准的建模方法。分子对接需要已有的蛋白质结构并限制灵活性,而AlphaFold能够对完全灵活的复合物进行模拟。这可以增强和加速以新蛋白质为靶点的合理药物设计。
“这一模型的扩展能力和性能将有助于加快生物医学的突破,实现数字生物学的下一个时代。它可以为了解疾病途径、基因组学、可再生生物材料、潜在治疗靶点的机制,以及推动蛋白质工程、合成生物学和改善植物免疫力等领域提供新的洞察力。”
准确预测这种扩展范围的生物分子的结构,为AlphaFold实现突破打开了新的可能性。合理药物设计可以从更好地建模配体和抗原-抗体复合物中受益。了解基因组机制依赖于核酸的结构。AlphaFold最近对蛋白质- RNA-DNA复合物进行建模,为CRISPR / Cas系统进行靶向基因编辑提供了更好的工具。
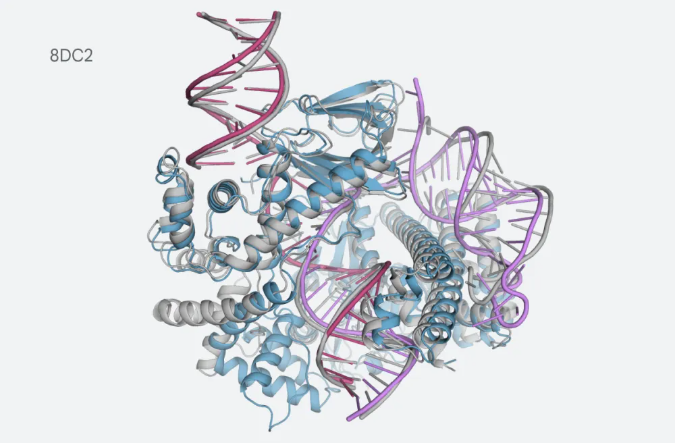
Isomorphic Labs已经开始应用该模型进行治疗设计,通过快速表征与疾病相关的大分子结构。全球各地的研究人员可以获得有关生物途径、疾病机制和潜在治疗靶点的新见解。此外,AlphaFold的能力还可以促进可再生生物产品的开发、植物研究和合成生物学工程。
这种AI快速准确地模拟多样化分子结构的演示代表了迈向"数字生物学"未来愿景的一大飞跃。在将数字模型校准为现实世界数据的过程中,这些模型有望以前所未有的速度、范围和细节提供生物学的见解。目前,AlphaFold的能力可以通过预测研究人员否则需要通过昂贵、费力的方法如X射线衍射或低温电镜等来确定的结构加速物理实验。
这一最新的模型反映了自AlphaFold于2020年首次解读蛋白质折叠问题以来,AI研究的持续进展。紧接着的AlphaFold Multimer模型在2021年对多链蛋白复合物进行了建模。2022年的AlphaFold 2模型通过大规模扩展数据库和提高准确性,使得几乎所有基因序列蛋白质的结构预测成为可能。
这一最新模型不仅仅局限于单一的蛋白质,而是对细胞生化活动中关键复合物进行建模。这一成果突显了现代AI系统能够捕捉生物数据中非常复杂的模式,这些模式几十年来一直难以用人工设计的算法捕捉。
研究人员强调,AlphaFold并非从零开始解决这些结构,而是通过对大量实验所确定的结构进行模式推断。然而,该模型能够适应建模新的分子类别,这突显了近年来AI突破背后的泛化能力。
通过预测这一系列关键分子的结构,AlphaFold的下一代产品有望加速生物医学的洞察和治疗应用。但这也展示了AI在增强对生命复杂分子机制的基本科学理解方面的潜力。
将AlphaFold应用到制药流程和基础研究工作流程中仍然面临着许多工作。但其快速发展的能力有望帮助科学家解开自然界最深奥的奥秘。